
Zapraszamy do zapoznania się z artykułem autorstwa Prof. dr hab. Macieja Szaleńca z Instytutu Katalizy i Fizykochemii Powierzchni im. Jerzego Habera Polskiej Akademii Nauk pt. „The rational based mutation opening new substrates to the glycil-radical enzyme„
Publikacja, która ukazała się w jednym z najbardziej prestiżowych periodyków chemicznych, ACS Catalysis, przedstawia historię sukcesu projektu, dotyczącego badań enzymów rodinków glicelowych, prowadzonych przez Prof. Macieja Szaleńca oraz Prof. Johanna Heidera.
Projekt wspierany był przez Klaster LifeScience Kraków podczas Life Science Open Space’ 2020.
Abstract
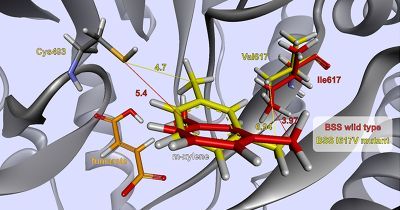
Anaerobic toluene degradation is initiated by adding toluene to fumarate via the glycyl radical enzyme benzylsuccinate synthase (BSS). We developed a recombinant production system producing active BSS and present data on the effects of some active-site mutants. A single substitution of Ile617 to Val inside a hydrophobic pocket of the active site leads to an extended substrate range of the variant, which includes conversion of m-xylene, but not of o– or p-xylene. Moreover, a mutation of the conserved Arg508, which participates in fumarate binding, to Lys or Gln decreases or eliminates BSS activity, proving its catalytic importance. Surprisingly, the Arg508Lys mutant gained the ability to synthesize a small amount of the product 3-benzyl-4-ketopentanoate from toluene and the fumarate analogue 3-acetyl acrylate. This study provides insight into substrate recognition by BSS and opens avenues for possible broader biotechnological applications in C–C bond formation.
Artykuł dostępny jest na stronie Międzyinstytutowego Laboratorium Biotechnologii i Katalizy Enzymatycznej oraz w ACS Publications.
