Badania kliniczne stanowią naturalny etap rozwoju nowych leków i technologii medycznych, a także wiarygodny drogowskaz na drodze do polepszania opieki nad pacjentem.
KCRI zostało założone w Krakowie w 2004 roku przez grupę lekarzy uniwersyteckich, jako organizacja świadcząca pełen zakres usług w dziedzinie badań klinicznych i edukacji. KCRI odpowiada za projektowanie, rozwój i realizację projektów badań klinicznych poprzez certyfikowany dział badań klinicznych (CRO), laboratoria oceny obrazów diagnostycznych (Core Lab) oraz dział zarządzania danymi/biostatystyki (Clinical Data Science).
KCRI zarządza kilkudziesięcioma długoterminowymi projektami klinicznymi rocznie i prowadzi operacje w ponad 20 krajach.
Poznaj strukturę KCRI
KCRI powołano by w sposób profesjonalny i wystandaryzowany wspierać rozwój medycyny.
Filozofią działań realizowanych w CRO jest dostarczanie lekarzom, naukowcom i podmiotom prowadzącym działalność naukową i badawczą (zarówno komercyjną jak i niekomercyjną) kompleksowych rozwiązań badawczych. Rozwiązania te pozwalających na efektywne prowadzenie projektów dotyczących innowacyjnych rozwiązań w zakresie ochrony zdrowia, nauk o życiu (Life Science) i edukacji.
Dział badań klinicznych (CRO) KCRI świadczy usługi we wszystkich zakresach wymaganych dla prowadzenia projektów badawczych:
- wsparcie prawne i regulacyjne,
- opracowywanie projektów i planów projektów badawczych,
- eksperckie wsparcie medyczne,
- selekcja i dobór właściwych ośrodków badawczych,
- monitorowanie projektów badawczych,
- zarządzanie projektem i wszystkimi skojarzonymi z nim procesami.
Kompleksowa usługa zarzadzania badaniem realizowana jest począwszy od idei aż do rozstrzygnięcia projektu. Wyznaczeni kierownicy projektów budują wśród zatrudnionych w KCRI fachowców zespoły projektowe dostosowane do specyfiki danego projektu, uwzględniając obszar terapeutyczny którego badanie dotyczy.
Uważamy, że każdy projekt badawczy, bez względu na jego wielkość i zasięg potrzebuje jednego spójnego standardu, dlatego z takim samym zaangażowaniem i profesjonalnym podejściem zarządzamy każdym z projektów.
KCRI aktualnie dysponuje wiedzą i zasobami pozwalającymi na wsparcie projektów badawczych zarówno wyrobów medycznych jak i produktów leczniczych.
Początkowo głównym kierunkiem naszych działań była obsługa badań klinicznych wyrobów medycznych. Jednak nie ograniczamy naszej aktywności od tej dziedziny. Począwszy od 2011 realizujemy projekty w zakresie badań produktów leczniczych terapii zaawansowanych (Advanced Therapy Medicinal Products (ATMP)) czy nowoczesnych terapii (w tym leków biologicznych) w onkologii.
SAFETY
Dział Bezpieczeństwa w KCRI zaangażowany jest na każdym etapie badań klinicznych produktów leczniczych oraz wyrobów medycznych. Począwszy od przygotowania i weryfikacji dokumentacji, po ciągły nadzór oraz raportowanie poważnych zdarzeń niepożądanych czy defektów wyrobów medycznych zarejestrowanych w trakcie trwania danego badania klinicznego.
Ponadto, Dział Bezpieczeństwa wspiera również organizację niezależnych komitetów zaangażowanych w monitorowanie bezpieczeństwa w badaniach klinicznych, w których zostały ustanowione, takich jak CEC (ang. Clinical Events Committee) czy DSMB (ang. Data Safety Monitoring Board).
Aktywności Działu Bezpieczeństwa pozwalają zagwarantować, że badanie prowadzone jest w oparciu o obowiązujące wytyczne i regulacje, z zachowaniem wysokich standardów bezpieczeństwa pacjentów biorących udział w badaniu.
MEDICAL
Dział medyczny w swojej strukturze zatrudnia lekarzy z szerokim doświadczeniem w zakresie organizacji i prowadzenia badań klinicznych, będących jednocześnie naukowcami aktywnie publikującymi w uznanych czasopismach medycznych. Dział medyczny zajmuje się wsparciem prowadzenia badania klinicznego na każdym etapie, od pierwszych założeń badaniach (hipotezy badawczej), przez tworzenie dokumentacji badania aż po analizę zdarzeń niepożądanych i bezpieczeństwa pacjenta będącego uczestnikiem badania. Innymi zadaniami zespołu są analizy dostępnej literatury naukowej oraz przygotowywanie raportów ocen klinicznych wyrobów.
CLINICAL DATA SCIENCE
Dział Zarządzania Danymi zajmuje się szeroko rozumianym przetwarzaniem oraz analizą statystyczną danych klinicznych. Obejmuje to zadania realizowanie w czasie trwania całego badania klinicznego, jak również przed jego rozpoczęciem oraz po jego zakończeniu.
Na najwcześniejszym etapie są to: oszacowanie wymaganej ilości pacjentów w badaniu (sample size calculation), tworzenie lub weryfikacja protokołu badania pod kątem zagadnień statystycznych, tworzenie Planu Analizy Statystycznej (Statistical Analysis Plan – SAP), tworzenie Planu Zarządzania Danymi (Data Management Plan – DMP) jak również tworzenie kart obserwacji klinicznej pacjenta (Case Report Form – CRF).
Stosowane są również nowoczesne techniki planowania badań uwzględniające dynamiczne szacowanie ryzyka czy modele adaptacyjne.
W takcie trwania badania dział zajmuje się bieżącą walidacją danych oraz raportowaniem postępów trwania badania. Po zakończeniu badania jednym z głównych zadań działu jest przeprowadzenie końcowej walidacji danych i analizy statystycznej oraz, na podstawie jej wyników, pomoc w sformułowaniu wniosków badania i przygotowania danych i opisów do publikacji.
CORELAB
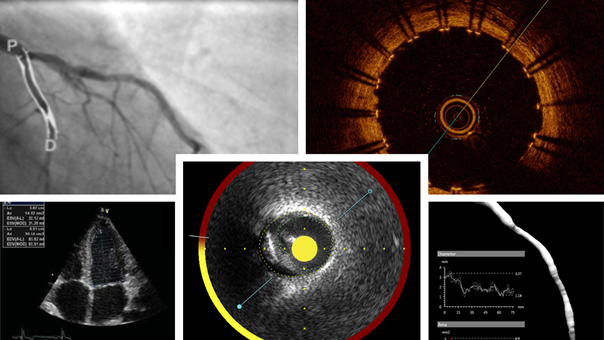
Dział Core Lab jest niezależnym laboratorium oceny obrazów i wyników diagnostycznych, który specjalizuje się w ilościowej i jakościowej analizie obrazowania serca i naczyń. Core Lab dostarcza profesjonalnych usług dla każdej skali badań klinicznych: od małych badań pilotażowych po wieloletnie, wieloośrodkowe, międzynarodowe badania kliniczne z zakresu wyrobów medycznych.
Core Lab posiada długoletnie doświadczenie w ilościowej i jakościowej analizie obrazów medycznych, w tym: ilościowej angiografii wieńcowej (Quantitative Coronary Angiography – QCA), ultrasonografii wewnątrznaczyniowej (IVUS) oraz optycznej tomografii koherentnej (OCT). W zakresie badań dotyczących strukturalnej choroby serca wykonywana jest analiza tomografii komputerowej (CT) oraz rezonansu magnetycznego (MRI).
Dodatkowo, w zakresie usług znajduje się również pełna analiza echokardiograficzna (Echo Core Lab), z oceną struktur mięśnia sercowego, weryfikacją i oceną funkcji skurczowej ( w tym odkształcenia metodą śledzenia markerów akustycznych) oraz funkcji rozkurczowej. Szczególnym zainteresowaniem objęte są badania weryfikujące stopień ciężkości wad zastawkowych, a także analiza badań z zakresu implantowanych wyrobów ( np. ocena po TAVI/TAVR, ocena PVL, ocena funkcji implantowanych zastawek).
Core Lab tworzy wykwalifikowany zespół inżynierów, techników oraz lekarzy zajmujących się obrazowaniem sercowo-naczyniowym. Dzięki długoletniemu doświadczeniu Core Lab jest zaangażowany w każdy etap badania klinicznego od opracowania metodologii i wytycznych przez wykonywanie analiz, aż po końcowe opracowanie wyników.
REGULATORY AFFAIRS
Dział do spraw regulacyjnych zajmuje się administrowaniem i nadzorowaniem współpracy z urzędami i komisjami w zakresie uzyskania zgód na prowadzenie badania klinicznego.
QUALITY
Dział zajmuje się zarządzaniem jakością zgodnie z obowiązującymi normami ISO (ISO 9001:2015, ISO 14155:2020) oraz regulacjami prawnymi w zakresie wyrobów medycznych i ochrony danych osobowych.
Pracuj w KCRI
Jako pracodawca mamy świadomość, że swoją postawą wpływamy na satysfakcje i poziom zadowolenia pracowników. Wierzymy, że szacunek jakim ich obdarzamy, zaufanie i otwartość na dialog jest tym, co buduje solidne podwaliny wzajemnych relacji. Głównym celem jako pracodawcy jest dla nas zbudowanie silnego i kompetentnego zespołu, a jednocześnie umożliwianie rozwoju naszych pracowników jako jednostek.
Niezwykle ważne jest dla nas tworzenie dynamicznego środowiska pracy – u nas każdy ma wpływ na całokształt procesu. Słuchamy, stawiamy ambitne cele, ale także wspieramy i motywujemy, bo wiemy jak duży potencjał tkwi w ludziach. Wymarzony pracodawca? Zapewne taki nie istnieje, ale taki jest nasz cel.
Chcesz przekonać się jak wygląda praca w KCRI? Wyślij swoje CV na adres: office@kcri.org
Będzie nam bardzo miło Cię poznać.
Materiały i treść do powyższego artykułu zostały dostarczone przez KCRI