Oporność na antybiotyki – narastający problem
W związku z narastaniem oporności bakterii na leki przeciwdrobnoustrojowe, istnieje rynkowa potrzeba stworzenia produktów niebędących antybiotykami ani chemioterapeutykami, które będą mogły zostać zastosowane w terapii, ograniczając tym samym presję związaną ze stosowaniem środków przeciwdrobnoustrojowych i zapobiec szerzeniu się oporności. Jest to spełnienie założeń zaproponowanych przez Komisję Europejską, dotyczących konieczności opracowania nowych, skutecznych środków przeciwdrobnoustrojowych lub rozwiązań alternatywnych do celów leczenia. Badacze wskazują na potrzebę wytworzenia alternatywnych metod leczenia zakażeń wywołanych przez patogeny wielolekooporne (Boucher et al., 2009; Nordmann et al., 2012). Podkreślają oni, że rozwiązaniem problemu antybiotykooporności szczepów niekoniecznie jest poszukiwanie całkiem nowych metod leczenia, ale zamiast tego – odkrycie na nowo metod stosowanych w przeszłości i niejako zapomnianych, między innymi terapii fagowej.
Terapia zakażeń wywołanych przez patogeny wielolekooporne
Terapia zakażeń związanych z patogenami wielolekoopornymi (MDR, ang. multidrug resistant) wymaga ogromnych nakładów finansowych. Szacunkowe dane mówią, że koszt leczenia pacjenta zakażonego szczepem MDR to około 20-30 000 dolarów – w samych tylko Stanach Zjednoczonych sumaryczny koszt terapii takich zakażeń to ponad 20 miliardów dolarów rocznie (Haddix et al., 2003). Leczenie zakażeń wywołanych przez patogeny MDR podnosi koszty terapii i wydłuża pobyt pacjenta w szpitalu. Unia Europejska oraz Stany Zjednoczone jednoznacznie wskazują, że jest ogromna rynkowa potrzeba poszukiwania nie antybiotykowych metod leczenia zakażeń wywołanych przez patogeny MDR (Gravitz et al.; 2012).
Zakażenia wywołane przez oporne na antybiotyki szczepy bakteryjne stanowią duże wyzwanie dla współczesnej medycyny. Stanowią one problem nie tylko w lecznictwie zamkniętym, ale także wśród populacji generalnej. Największe zagrożenie stanowią mikroorganizmy określane wspólnie jako „ESKAPE/ESCAPE” (Rice, 2009). Nazwa ta stanowi akronim od pierwszych liter nazw następujących patogenów: Enterococcus faecium, Staphylococcus aureus, Clostridioides difficile, Acinetobacter baumannii, Pseudomonas aeruginosa i Enterobacterales , a która jednocześnie podkreśla fakt, że szczepy te „uciekają” (ang. escape) od możliwości stosowania wobec nich antybiotyków. Kliniczne znamienny jest fakt, że patogeny z grupy ESKAPE są często hiperwirulentne i cechują się obecnością licznych mechanizmów oporności na leki przeciwdrobnoustrojowe, co bezpośrednio wpływa na niepowodzenia terapeutyczne, a także przedłużanie terapii i – co za tym idzie – wzrost kosztów leczenia.
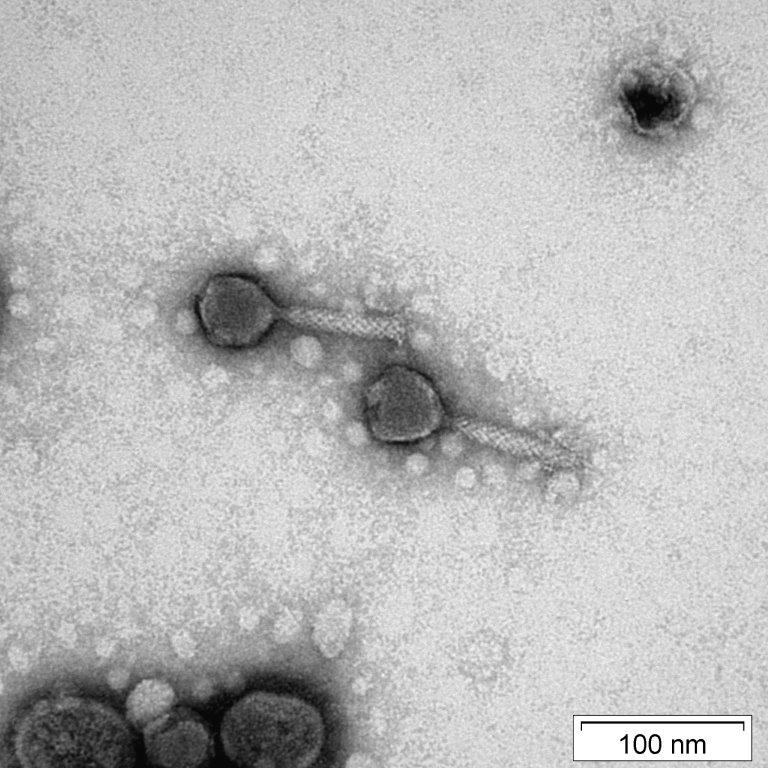
Terapia bakteriofagowa nadzieją i szansą
Ogromną szansą na leczenie zakażeń wielolekoopornych może być terapia
fagowa. Bakteriofagi (fagi) to wirusy, dla których gospodarzami są bakterie. Bakteriofagi są szeroko
i łatwo dostępne niemal wszędzie, gdzie żyją bakterie. Izolowane są z różnych środowisk
i nisz ekologicznych m.in.: z wód śródlądowych, gorących źródeł, gleby, ścieków.
Szacuje się, że w biosferze znajduje się około 1030–1031
fagów, co stanowi 10-krotnie większą liczbę niż bakterii. Fagi są nieodłącznym
elementem ludzkiego mikrobiomu, dlatego są dobrze tolerowane i używane w
terapii. W przeciwieństwie do antybiotyków, które działają zarówno na bakterie
patogenne, jak i na składniki flory fizjologicznej, bakteriofagi są wysoce
specyficzne – działają na jeden gatunek, albo wyłącznie jeden szczep bakterii. Do
zalet zastosowania fagów w terapii można zaliczyć wąskie spektrum działania – bakteriofagi
często są aktywne wobec jednego gatunku lub nawet szczepu. Jak wspomniano
fagoterapia nie wpływa na florę fizjologiczną – bakteriofagi eradykują tylko
bakterie, które są ich bezpośrednim celem. Mikrobiota człowieka (szczególnie jelitowa) pozostaje nienaruszona, i
może współuczestniczyć w eliminacji patogenu, który wywołał zakażenie. U pacjenta nie obserwuje się zatem efektów
ubocznych, takich jak przy stosowaniu antybiotykoterapii. Ponadto istnieją
dowody na efektywną penetrację fagów w głąb biofilmu, gdzie w przypadku
antybiotyków jest to niezwykle trudne. Namnażanie się fagów w komórkach
bakteryjnych prowadzi do ich lizy, a w konsekwencji do ich śmierci. Dlatego także białka
fagowe odpowiedzialne za proces lizy są postrzegane jako przyszła alternatywa
dla innych środków przeciwbakteryjnych. Należy podkreślić, że jeśli
w organizmie nie ma patogenu, przeciw któremu skierowane są fagi, nie mogą one
namnażać się, i są wydalane, natomiast antybiotyk nawet, gdy w organizmie nie
ma patogenu (lub patogen jest oporny) przeciw któremu skierowany był
antybiotyk, pozostaje on w wysokim stężeniu, niejednokrotnie toksycznie
wpływając na komórki organizmu oraz florę fizjologiczną.
Bank bakteriofagów Biophage Pharma
Stworzenie banku bakteriofagów przeciwko wielu gatunkom bakterii umożliwia szybkie wytworzenie produktu leczniczego „na żądanie”, lub w sytuacji, kiedy globalne trendy oporności szczepów bakteryjnych ulegną zmianie. Sytuacja związana z opornością patogenów i pojawianiem się nowych szczepów zagrażających zdrowiu i życiu ludzi zmienia się dynamicznie. Ponieważ ciężko przewidywać trendy, należy opierać się na prowadzonych obserwacjach, z których jednoznacznie wynika, że co kilka lat dochodzi do pojawiania się „nowych superbakterii”. Szczepy uważane dawniej za komensalne, środowiskowe, lub niegroźne dla ludzi składniki mikrobiomu, stały się w ostatnich latach dużym wyzwaniem terapeutycznym. Stworzony przez firmę bank stanowi kolekcję scharakteryzowanych i opisanych bakteriofagów przeciwko wielu gatunkom bakterii. Firma posiada kolekcja fagów dla szczepów Gram-ujemnych, ale także dla szczepów Gram-dodatnich. Zgromadzone w banku fagi są sukcesywnie opracowywane, charakteryzowane, a także testowane na licznych klinicznych szczepach bakteryjnych. Planuje się sukcesywnie powiększać posiadaną kolekcję o kolejne bakteriofagi.
Boucher H. W., Talbot G. H., Bradley J. S., Edwards J. E., Gilbert D., Rice L. B., et al. Bad bugs, no drugs: no ESKAPE! An update from the Infectious Diseases Society of America. 2009; Clin. Infect. Dis. 48 1–2.
Gravitz L. Turning a new phage. Nat Med. 2012;18:1318–20.
Haddix AC, Teutsch SM, Corso PS, Prevention effectiveness: a guide to decision analysis and economic evaluation. New York: Oxford University Press 2003; p 345-357.
Nordmann P., Dortet L., Poirel L. Carbapenem resistance in Enterobacteriaceae: here is the storm! Trends Mol. Med. 2012; 18 263–272.
Rice LB. Federal funding for the study of antimicrobial resistance in nosocomial pathogens: no ESKAPE. J Infect Dis 2009;197:1079-81.
Autorki:
Dr n. biol. Aneta Buda – Specjalista Mikrobiolog w Spółce Biophage Pharma S.A., autorka publikacji oryginalnych i przeglądowych, specjalista w zakresie charakterystyki molekularnej i oporności patogennych szczepów bakteryjnych, izolacji i charakterystyki bakteriofagów oraz szczepów probiotycznych.
Mgr Estera Jachowicz – Specjalista Mikrobiolog w Spółce Biophage Pharma S.A., szczególnie zainteresowana tematyką zakażeń wywołanych przez Clostridium difficile, specjalista w zakresie bakteriofagów i szczegółowej charakterystyki ich cykli życiowych.

