
W jednym z najnowszych raportów FDA na temat globalnego udziału w badaniach klinicznych w latach 2015-16 Polska wskazana jest jako czwarty co do wielkości ośrodek badań klinicznych na świecie, z szacowaną rekrutacją > 5000 uczestników badań, co stanowi prawie 4% rekrutacji światowej (Rysunek 1).[1]
Ponadto, jeśli chodzi o Unię Europejską,, Polska zajmuje drugie miejsce za Niemcami (4,4%) i zajmuje pierwsze miejsce wśród krajów Europy środkowo-wschodniej.
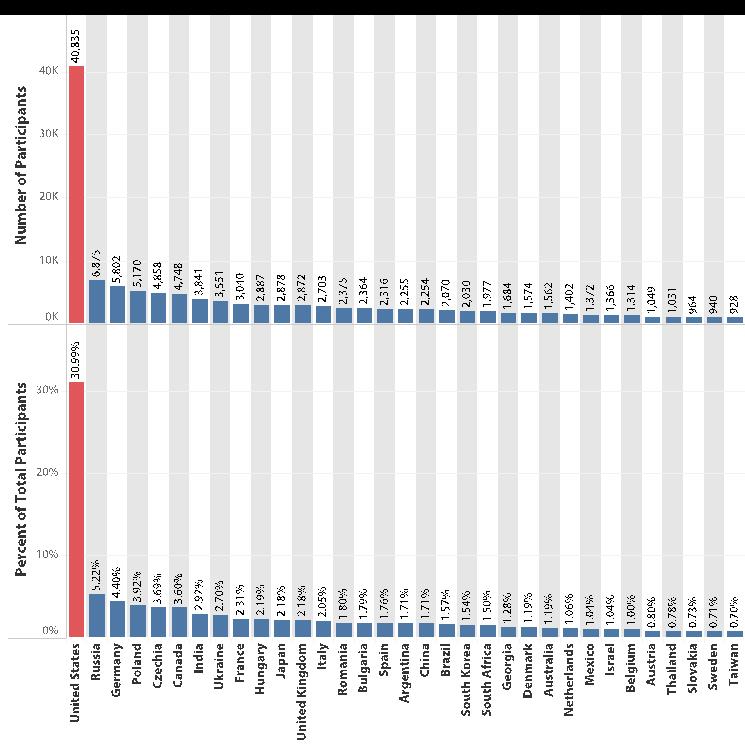
Źródło: US FDA
Główne czynniki wpływające na rekrutację pacjentów
Zapewne najważniejszym czynnikiem przy rekrutacji pacjentów jest rozpowszechnienie jednostki chorobowej będącej przedmiotem badania Kiedy schorzenie jest dość rzadkie w regionie lub kraju, trudno będzie znaleźć pacjentów spełniających kryteria włączenia. Dlatego też większość sponsorów i firm CRO oceniając możliwości przeprowadzenia badania (proces feasibility) bierze przede wszystkim pod uwagę powszechność występowania choroby.
Jeśli chodzi o ośrodki, powodzenie rekrutacji jest również zależne od ich lokalizacji (centralna czy odległa), specjalizacji (np. ośrodki onkologiczne, ośrodki leczenia chorób serca, kliniki diabetologiczne itp.) oraz odpowiedniego wyposażenia ośrodka koniecznego do przeprowadzenia badania klinicznego.
Nie można przecenić dobrze zaprojektowanego protokołu, ponieważ jest to jedno z podstawowych narzędzi do przeprowadzenia badania. Wysokiej jakości protokół badania będzie służył badaczowi do uzyskania wysokiej jakości danych i prawidłowego włączenia odpowiednich pacjentów.
Rodzaj i zakres usług świadczonych przez firmę CRO również mogą wpływać na rekrutację pacjentów. Doświadczona firma CRO, posiadająca wiedzę w zakresie wyboru odpowiednich ośrodków i identyfikowania docelowej grupy pacjentów w krajach, w których prowadzi działalność, może dostarczyć sponsorowi cennych informacji, co pośrednio również może wpłynąć korzystnie na rekrutację pacjentów. Dobre relacje monitora z badaczem i personelem ośrodka, odpowiednie wsparcie, dostępność i szybka reakcja w przypadku pojawiających się problemów w badaniu, mogą mieć kluczowe znaczenie dla powodzenia rekrutacji.
W końcu nie można zapominać o jednym z najważniejszych czynników wpływających na dobrą rekrutację – badaczu, który nawiązuje relację z potencjalnym uczestnikiem badania, cierpliwie wyjaśnia cel i plan badania, zdobywa zaufanie pacjenta, a w efekcie odnosi sukces w rekrutacji.
Oprócz tych ogólnych czynników należy również wziąć pod uwagę konkretne elementy, które mają wpływ na rekrutację pacjentów. Można je ogólnie zaklasyfikować jako dotyczące pacjenta (świadoma zgoda) i dotyczące zespołu badania.
Świadoma zgoda na udział w badaniu klinicznym
Świadoma zgoda jest nie tylko wymogiem prawnym i etycznym, ale może być także jednym z warunków sukcesu w rekrutacji. Pacjent, który jest dobrze poinformowany o celu badania klinicznego, procedurach i czasie trwania badania, wsparciu, które otrzyma i zastosowanych środkach bezpieczeństwa, nie tylko wykazuje zainteresowanie badaniem, ale jest również bardziej skłonny postępować zgodnie z protokołem badania. To z kolei zmniejsza liczbę naruszeń protokołu i zwiększa prawdopodobieństwo zatrzymania pacjenta w badaniu. Kluczem do sukcesu jest klarowne sformułowanie Informacji dla Pacjenta oraz Formularza Świadomej Zgody, do których wytyczne zostały określone przez ICH GCP. [2]
Rola badacza i zespołu badawczego
Często zapominamy o kluczowej rola badacza w procesie pozyskiwania świadomej zgody pacjenta. W swojej świetnej prezentacji na jednym z warsztatów Stowarzyszenia na Rzecz Dobrej Praktyki Badań Klinicznych w Polsce dr Ewa Czernecka, doświadczona badaczka, omówiła znaczenie procesu poinformowania i pozyskania świadomej zgody pacjenta w rekrutacji i utrzymania pacjenta w badaniu. Dr Czernecka podkreśliła potrzebę stworzenia przyjaznej atmosfery w ośrodku, wskazała konieczność przekazywania informacji w sposób jasny i dostosowany do danego pacjenta oraz udzielania odpowiedzi na pytania pacjenta, okazywania uwagi i szacunku pacjentowi oraz budowanie partnerstwa między pacjentem a badaczem w celu osiągnięcia sukcesu w rekrutacji pacjentów. Przestrzegając tych zaleceń zwiększamy szansę na utrzymanie dobrych relacji z pacjentem przez cały czas trwania badania.
Zapewnienie utrzymania pacjentów w badaniu
Omawiając rekrutację pacjentów należy również wziąć pod uwagę kwestię zapewnienia ciągłego zaangażowania pacjenta aż do momentu zakończenia jego udziału w badaniu. Tutaj również, podobnie jak w momencie włączenia do badania, dużą rolę odgrywa relacja pacjent ‑ badacz / zespół badawczy. Personel badawczy powinien upewnić się, że pacjent jest prawidłowo informowany na wszystkich etapach badania, szczególnie w odniesieniu do nowych informacji dotyczących bezpieczeństwa lub zmian protokołu. Należy także pamiętać, że mogą zdarzyć się sytuacje, które uniemożliwiają pacjentowi przyjazd na wizytę i starać się znaleźć dogodną alternatywę.
Według badania opublikowanego w 2016 r. przez PwC, kluczową przewagą Polski nad krajami UE-15 była między innymi skuteczna rekrutacja pacjentów[3]. Jesteśmy dumni, że możemy być częścią tego sukcesu –badania prowadzone przez ACT słyną z wyjątkowo wysokiego wskaźnika rekrutacji pacjentów w polskich ośrodkach. Wynika to między innymi z naszego doświadczenia w doborze odpowiednich ośrodków i badaczy, prowadzeniu szkoleń personelu, opracowywaniu dobrze skonstruowanych formularzy Informacji dla Pacjenta i skutecznego monitorowania badań. Ponadto ACT oferuje również specjalistyczne usługi takie jak wizyty pielęgniarskie w domu pacjenta, w celu przeprowadzenia niektórych procedur badania, pobrania próbek, itp. Zajmujemy się również innymi czynnościami operacyjnymi takimi jak np. refundacja kosztów dojazdu pacjentów na wizyty i rozliczanie kosztów badania w imieniu sponsora. Podsumowując, usługi te odgrywają ważną rolę w udanej rekrutacji pacjentów.
Jakość w badaniach klinicznych
ACT wspiera również dobre inicjatywy w zakresie edukacji w badaniach klinicznych. INFARMA, Stowarzyszenie na Rzecz Dobrej Praktyki Badań Klinicznych w Polsce i POLCRO wydały ulotkę skierowaną do polskich badaczy: „Jakość w badaniach klinicznych”.
Polecamy!

Autor: Krystyna Iwińska, Advanced Clinical Trials krystyna.iwinska@actrials.com
Profil LinkedIn
[1] FDA 2015 – 2016 Global participation in clinical trials report (2017). Available from: https://www.fda.gov/media/106725/download
[2] ICH GCP. Informed consent of trial subjects. Available at: https://ichgcp.net/48-informed-consent-of-trial-subjects/
[3] PricewaterhouseCoopers Group. Clinical trials in Poland. December 2015. Available at: https://www.pwc.pl/pl/pdf/clinical-trials-in-poland-pwc-report.pdf



